D'incroyables cristaux de glace dans l'eau stellaire de l'Univers
16 Juillet 2025 | Par Rosu-Finsen, Salzmann, Davies, Murray, Brukhno, Fu | Actualités

De la glace amorphe aux cristaux d'eau : remise en cause de nos connaissances fondamentales
L'étude menée par Alexander Rosu-Finsen et Christoph G. Salzmann de l'University College London remet en question près de 90 ans de compréhension scientifique sur la nature de la glace amorphe de faible densité = LDA. Cette forme de glace, que l'on trouve abondamment dans les noyaux de comètes et sur les lunes glacées de notre système solaire, était jusqu'à présent considérée comme un matériau entièrement désordonné, similaire à un verre.
Le diagramme général de phase de l'eau
La figure ci-dessous résume le diagramme de phase pour l’eau dans un régime de pression très large, jusqu’à des pressions aussi élevées que celles rencontrées à l’intérieur des géants de la glace, Uranus et Neptune. Le pentamère de Walrafen ne se décompose qu’à des pressions ultra-élevées, supérieures à 50 GPa. Dans ce régime de pression, l’atome d’hydrogène devient centré entre les deux atomes d’oxygène. La nature moléculaire du H2O se décompose en deux étapes. Tout d’abord, les atomes H sautent d’avant en arrière entre les deux atomes O (dynamique VII/X sur la figure 1). Deuxièmement, les atomes H restent statiques au centre (appelés glace solide atomique X). Les chiffres romains sont utilisés pour les phases glaciaires, suivant l’ordre chronologique de la déduction de leurs structures cristallines. La glace X a été fabriquée en laboratoire en 1984 et représente le 10e polymorphe de H2O. Il ne fond pas lorsqu’il est chauffé au-delà de 2500 K. Il connaît plutôt une transition dynamique : les atomes H commencent à être mobiles dans un réseau d’atomes O restant à des positions fixes, une propriété connue sous le nom de supériorité. Cette glace, appelée glace XVIII depuis 2019, n’a été découverte que très récemment lors d’expériences radiographiques sur de l’eau soumise à un choc laser. La glace XVIII est presque aussi conductrice que les métaux. En effet, les atomes H délocalisés dans la glace superionique jouent le même rôle de porteurs de charge que les électrons délocalisés dans les métaux. D’après les conditions des expériences, Uranus et Neptune pourraient effectivement contenir de la glace superionique dans leurs manteaux, mais cela est incertain car on ne sait pas comment les contaminations, par exemple, par le carbone, affectent leur comportement. La façon dont la structure de la glace est affectée à des pressions encore plus élevées ne peut être prédite que dans des simulations. Les expériences sur les ondes de choc et les cellules d’enclume en diamant biseauté sont actuellement limitées à 300 GPa (3 Mbar). Au-dessus d’environ 300 GPa, on prévoit une gamme de nombreuses autres structures X post-glace qui n’ont pas encore été découvertes dans l’expérience. Leurs groupes d’espace sont donnés à l’extrémité haute pression sur la figure 1.
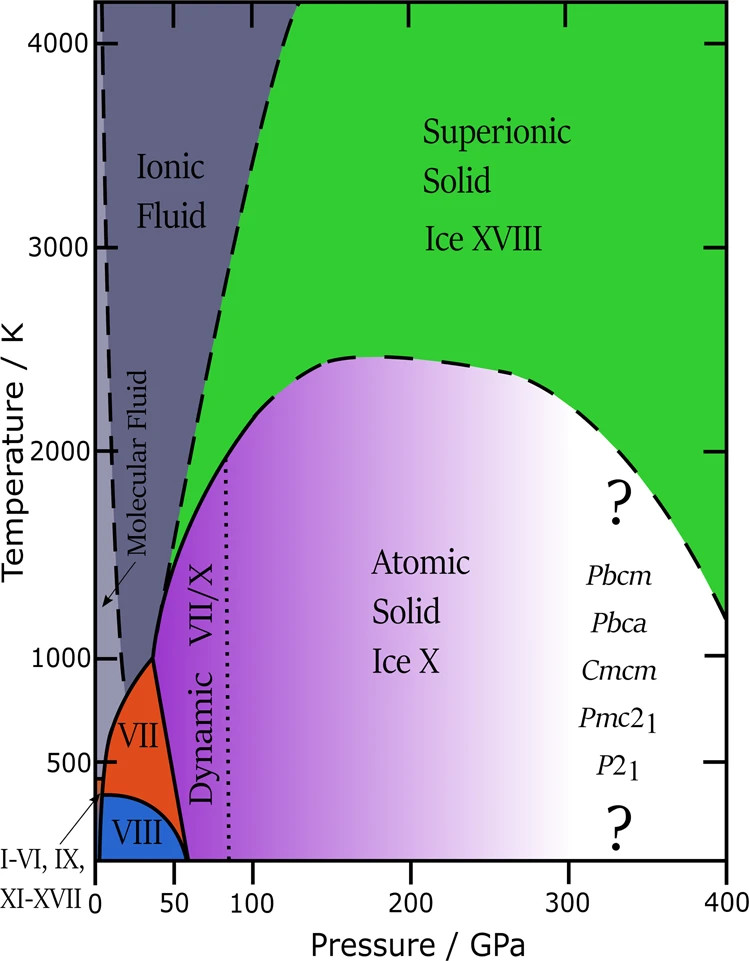
Fig 1. Phases stables de glace et d’eau liquide à des températures allant jusqu’à 4000 K et à des pressions ultra-élevées de 400 GPa. Le gris indique l’eau liquide moléculaire et ionique. Le bleu indique la glace H-ordonnée VIII, le rouge indique la glace H-désordonnée VII. Le violet indique la glace solide atomique X, dans laquelle les atomes H sont au centre entre deux atomes O. La ligne pointillée sépare la glace X de la glace VII, dans laquelle les atomes H sont centrés en moyenne temporelle, mais localisés en instantané. Le vert indique la glace XVIII dans laquelle les atomes H sont mobiles et délocalisés dans un réseau fixe d’atomes O. Les lignes en pointillés sont des estimations. Les polymorphes prédits post-glace X comme candidats pour une découverte expérimentale future sont répertoriés à l’extrémité ultra-haute pression.
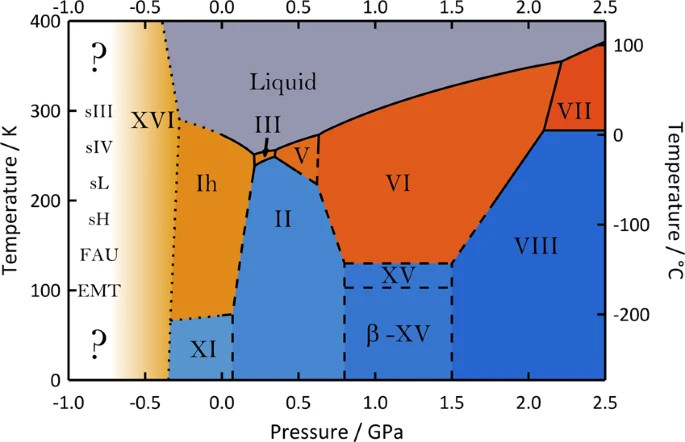
Diagramme de phase de l'eau en pression négative
Une approche expérimentale combinant simulations et laboratoire
Etude par diffraction des rayons X de gouttelettes d’eau congelées.
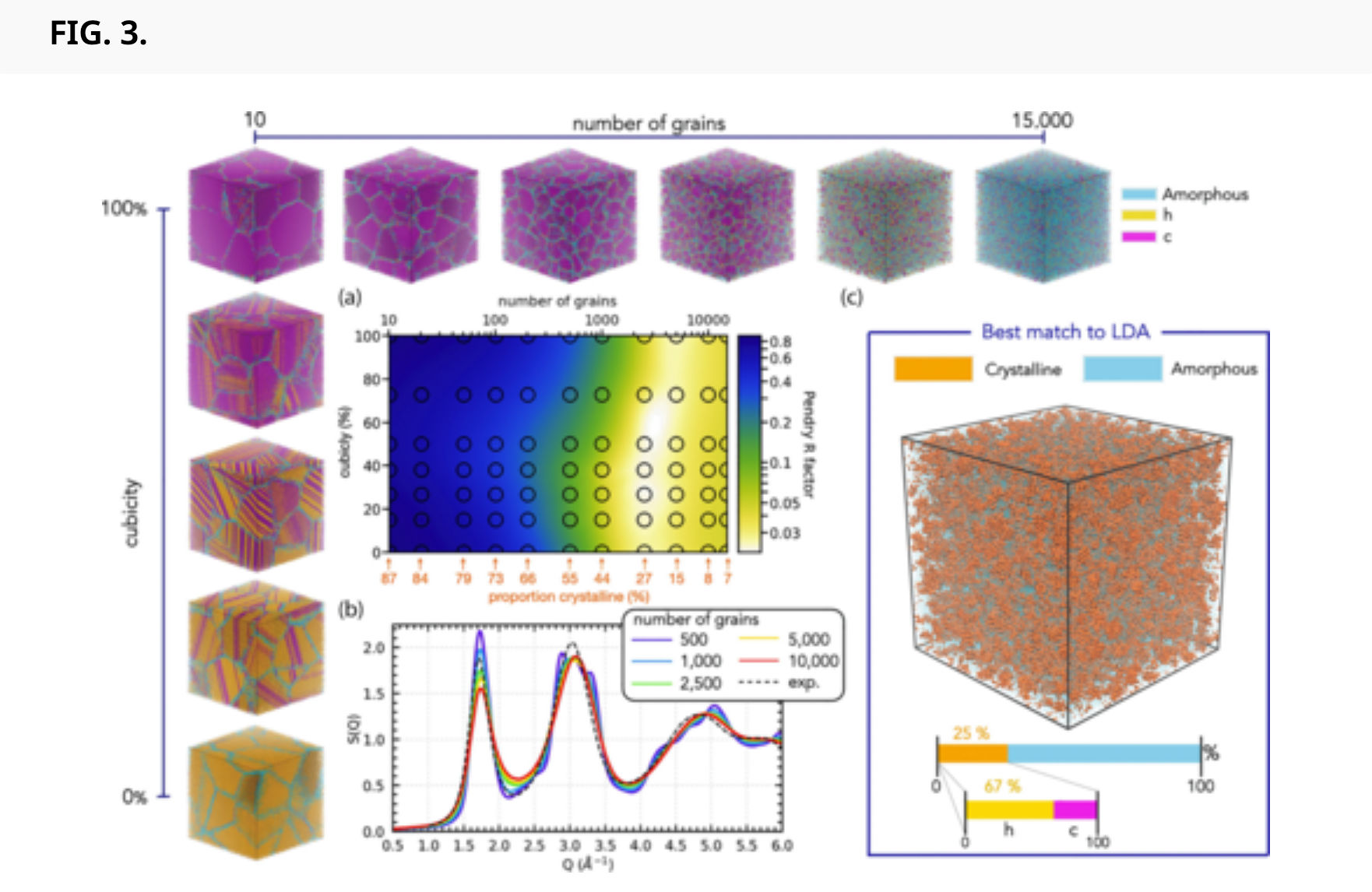
Construction de LDA avec des domaines de Voronoï contenant de la glace cristalline. L’accord entre les systèmes expérimentaux et polycristallins a été exploré pour des systèmes modèles à travers une grille de différents niveaux de cubicité (désordonnée par empilement) (du sous-ensemble de molécules dans des environnements cristallins) et de polycristallinité (donnée par le nombre de grains). Des instantanés des limites supérieure et gauche de la grille ornent les limites de la figure, et les diamètres moyens approximatifs des grains sont représentés à la figure S5. a) Carte thermique du facteur 𝑅 de Pendry pour l’accord de la 𝑆(𝑄) entre l’expérience et les systèmes modèles, et les systèmes de calcul en fonction de la proportion de molécules avec des environnements glaciaires cristallins et de la cubicité. (b) Le calcul 𝑆(𝑄) avec un accord optimal avec l’expérience pour différents niveaux de polycristallinité. c) Instantané du système qui correspond le mieux aux données expérimentales, avec indication de ses environnements atomiques locaux. Le système contient environ 320 000 molécules d’eau.
Afin de déterminer la structure cristalline de la glace qui cristallise de façon homogène à partir de l’eau surfondue, des gouttelettes d’eau sont mises en suspension dans une matrice huileuse par émulsification et la phase de glace qui se forme est suivie par diffraction des rayons X (voir Méthodes).
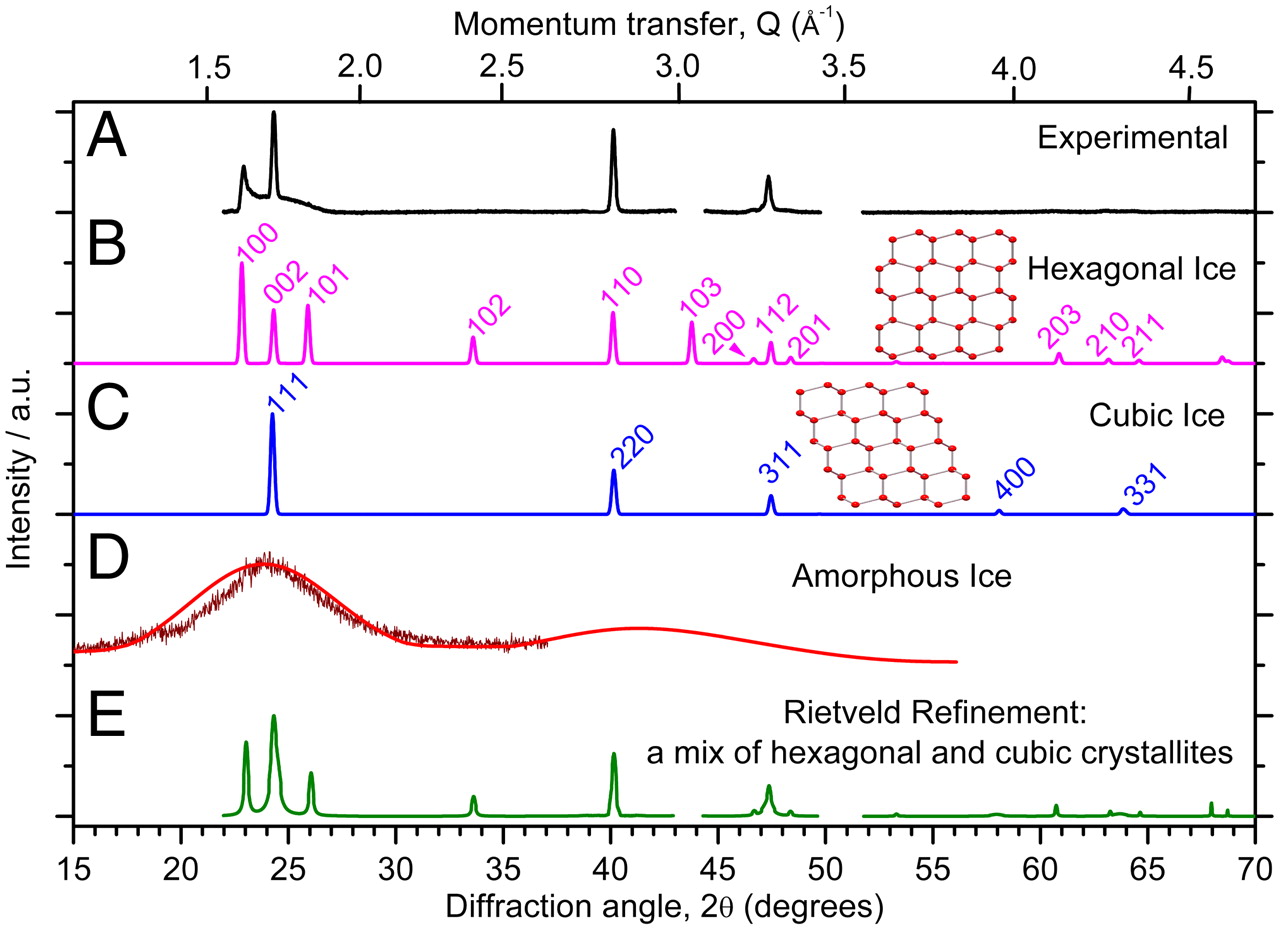
La comparaison du diagramme de diffraction des gouttelettes congelées de 0,9 μm qui ont gelé autour de 232 K (figure 1A) avec le diagramme calculé pour la glace Ih (figure 1B) révèle que les pics hexagonaux caractéristiques à environ 26°, 34° et 61° 2θ, qui sont les pics 101, 102 et 203 de la glace Ih, sont absents, alors que les intensités des pics restants sont incompatibles avec la glace Ih. Notre diagramme de diffraction est semblable à de nombreux autres diagrammes publiés dans la littérature, qui ont été identifiés comme étant de la glace Ic (p. ex., les réfs. 3, 4, 19 et 23). Cependant, la comparaison du patron expérimental avec le patron calculé numériquement pour la glace Ic (figure 1C) révèle des écarts évidents. Le patron expérimental présente un fort pic à environ 23° (correspondant au pic de 100 de glace Ih) et la région comprise entre environ 23° et 26° est élevée au-dessus de la ligne de base; ces deux caractéristiques sont incompatibles avec la symétrie cubique. De plus, les intensités relatives des pics des trois pics primaires de glace Ic sont mal adaptées au motif expérimental, et les pics d’angle élevé (environ 58° et 64° correspondent aux pics de glace Ic 400 et 331) sont absents. Dans le passé, il a été suggéré que la cristallisation de la glace amorphe lors du chauffage est incomplète, ce qui donne un mélange de glace cristalline et de glace amorphe (23, 24). La comparaison de notre motif expérimental (figure 1A) avec des motifs amorphes de la littérature (figure 1D) montre clairement que notre échantillon ne contient pas de glace amorphe. Il ressort également d’un raffinement de Rietveld (figure 1E) que le matériau métastable n’est pas un simple mélange de phases de cristallites de glace Ic et de glace Ih. En résumé, il ressort de ces diagrammes de diffraction que la glace, qui cristallise dans l’eau surfondue, n’est ni de la glace Ic, ni de la glace Ih, ni un mélange de phases distinctes.
L'approche expérimentale de cette étude remarquable repose sur une méthodologie hybride innovante combinant des simulations informatiques avancées et des expériences en laboratoire. Les chercheurs ont utilisé deux modèles d'eau largement reconnus dans le domaine scientifique (TIP4P et autres modèles computationnels) pour simuler la formation de glace amorphe en refroidissant de l'eau liquide de 300 K à 125 K à différentes vitesses23. Cette approche computationnelle leur a permis de générer des "cubes de glace" virtuels présentant différents degrés de cristallinité, allant de structures complètement cristallisées à des grains cristallins noyés dans une matrice amorphe3.
Pour valider leurs simulations, les scientifiques ont ensuite calculé les diagrammes de diffraction des rayons X de ces structures simulées et les ont comparés aux données expérimentales publiées dans la littérature scientifique23. Cette comparaison révélatrice a montré que les échantillons de glace avec 16 à 19% de cristallinité reproduisaient le mieux les observations expérimentales3. Cette découverte computationnelle a été corroborée par des techniques de diffraction des rayons X à grand angle (WAXS) qui permettent d'analyser la structure des matériaux amorphes jusqu'à des distances interatomiques de 23 Å45.
La glace amorphe de faible densité contient des cristaux de glace cristallins
Étude de cas :
Motifs de diffraction des rayons X expérimentaux et calculés. (A) Un diagramme de diffraction expérimental pour les gouttelettes d’eau (diamètre médian en volume = 0,9 μm) qui gèlent de façon homogène avec une température médiane de congélation de 231,7 ± 1 K lors du refroidissement à 30 K min-1 enregistré à environ 173 K. (B et C) Des diagrammes de diffraction simulés utilisant DIFFaX de glace Ih et de glace Ic complètement ordonnées, respectivement. (D) Les patrons de diffraction de la littérature sur la glace amorphe de Dowell et Rinfret (23) en dessous de 113 K (rouge vif) et de Shilling et al. (19) à 90 K (rouge foncé). (E) Le résultat d’un raffinement de Rietveld au modèle expérimental, en supposant un mélange de glace bien cristallisée Ic et de glace Ih. Les écarts dans le motif expérimental correspondent à des pics de diffraction du support d’échantillon.
Cette étude, publiée dans Physical Review B en juillet 2025, se concentre sur la glace amorphe de faible densité (LDA), l'un des matériaux solides les plus répandus dans l'univers et un matériau clé pour comprendre les anomalies de l'eau liquide. Malgré son importance et sa découverte il y a près de 90 ans, la structure de la LDA fait toujours débat dans la communauté scientifique.
Le débat central porte sur la nature exacte de la LDA : s'agit-il d'un état vitreux représentant un liquide ou d'un cristal fortement désordonné ? Dans la littérature scientifique, deux formes ont été identifiées (LDA-I et LDA-II) qui ont été décrites respectivement comme amorphe et partiellement cristalline.
Méthodologie de l'étude
Les chercheurs ont utilisé deux modèles d'eau largement reconnus pour démontrer que le facteur de structure expérimental de la LDA est mieux reproduit computationnellement par une structure partiellement cristalline. La méthodologie combine approches computationnelles et expérimentales pour analyser la structure de la glace amorphe.
Résultats principaux
L'étude révèle que les modèles pour LDA-I et LDA-II sont très similaires, avec des différences dues uniquement à de subtiles variations de cristallinité et/ou à des erreurs expérimentales. Cette découverte unifie la compréhension de ces deux formes précédemment considérées comme distinctes.
Preuve expérimentale : l'effet mémoire
Un support supplémentaire pour ce modèle structural provient d'expériences spécifiques : si la LDA est partiellement cristalline, alors sa voie de formation devrait résulter en différentes cubicités de nanocristallites et donc donner lieu à différentes cubicités lors de la recristallisation. Cet effet mémoire de la voie de création de la LDA a été observé expérimentalement et est incompatible avec un matériau entièrement amorphe.
L'expérience de l'effet mémoire : une preuve décisive
L'aspect le plus fascinant de cette recherche réside dans la démonstration expérimentale de ce que les chercheurs appellent "l'effet mémoire" de la glace amorphe. Les scientifiques ont préparé différents échantillons de glace LDA en utilisant diverses techniques de formation en laboratoire, puis ont réchauffé ces échantillons de la température de formation (très basse) jusqu'à 0°C, où une transition vers la glace cristalline était attendue.
Le résultat fut remarquable : les échantillons ont adopté des structures cristallines non homogènes, conservant une "mémoire" de leur phase parent. Cette observation est incompatible avec un matériau entièrement amorphe, car seuls les matériaux contenant des régions cristallines peuvent préserver de telles informations structurelles lors du réchauffement. L'effet mémoire se manifeste par des différences dans ce que les scientifiques appellent la "cubicité" des nanocristallites – la proportion de séquences cubiques par rapport aux séquences hexagonales dans la structure cristalline.
Des techniques d'analyse structurelle de pointe
Les chercheurs ont également employé des techniques spectroscopiques avancées, notamment la spectroscopie Raman, pour analyser les changements structurels dans les échantillons de glace. Ces méthodes permettent d'identifier les différentes phases de la glace et de suivre les transitions entre les états amorphe et cristallin. La microscopie électronique à transmission à basse température (cryo-EM) a également été utilisée pour observer directement la croissance des cristaux de glace à l'échelle nanométrique.
Implications pour notre compréhension de l'eau
Cette découverte révolutionnaire a des implications profondes pour notre compréhension de l'eau liquide et de ses anomalies célèbres. Si la glace amorphe de faible densité n'est pas entièrement amorphe mais partiellement cristalline, cela pourrait modifier notre compréhension des propriétés fondamentales de l'eau liquide. Cette "réidentification" d'un matériau si intensément étudié souligne également la nécessité d'une grande prudence dans la classification de la nature des matériaux vitreux à l'avenir.
L'étude démontre que la science continue d'évoluer et que même les matériaux les plus étudiés peuvent encore nous réserver des surprises. Cette recherche ouvre la voie à de nouvelles investigations sur la possibilité de créer une glace véritablement amorphe et sur les rôles multiples que joue la glace LDA dans la nature.
Les études de références :
https://journals.aps.org/prb/abstract/10.1103/PhysRevB.112.024203
https://www.pnas.org/doi/10.1073/pnas.1113059109
https://www.nature.com/articles/s42004-020-00349-2
https://pubs.aip.org/aip/jcp/article/144/20/204502/913959/A-new-structural-relaxation-pathway-of-low-density
https://pmc.ncbi.nlm.nih.gov/articles/PMC10827800/