Structure des gemmes naturelles d'origine organique
10 Mars 2016 | Par Cuif J.P., Dauphin Y., Sorauf J.E | Cristaux et sciences

Bio-cristaux : une croissance cristalline biochimiquement contrôlée
[08-03-2011]
Les cristaux calcaires qui forment les coquillages ou les squelettes des coraux, par exemple, présentent des propriétés tellement surprenantes que la question de leur mode de formation n'est pas encore résolue depuis plus d'un siècle et demi. Comme ces biocristaux enregistrent au cours de leur formation certaines propriétés de l'environnement, ils ont pris une importance grandissante pour l'étude des variations climatiques. D'où la nécessité d'une meilleure compréhension du processus par lequel les organismes contrôlent cette cristallisation.
L'utilisation de méthodes très résolutives a permis aux chercheurs du groupe Biominéraux de IDES-Orsay (CNRS-INSU, Univ. Paris XI) de décrire l'organisation des biocristaux et de reconstituer leurs modalités de formation. Dans un ouvrage de synthèse récemment publié aux Cambridge University Press ils présentent cette progression dans l'analyse structurale et biochimique, depuis la morphologie jusqu'à l'échelle infra-micrométrique.
Les biocristaux défient les lois de la cristallographie : le paradoxe morphologique

C'est en 1844 que J.S. Bowerbank (1), un des membres fondateurs de la Microscopical Society de Londres, publia la première étude concernant la structure des coquilles de mollusques. Il fut le premier à s'intéresser non seulement à leur morphologie, comme le faisaient les collectionneurs, mais à l'organisation du matériel calcaire qui les constitue. Grâce aux premiers microscopes véritablement fonctionnels, il mit en évidence le fait que la calcite et l'aragonite des coquilles des mollusques ou des polypiers des coraux ne se présentent pas comme de simples agrégats inorganisés, mais forment des couches distinctes, composées d'unités à morphologies bien définies, et arrangées dans l'espace selon des dispositions propres à chaque famille ou genre d'organismes (Fig. 1). L'évidence du contrôle biologique sur la croissance de ces unités fut immédiatement reconnue, de même que le caractère énigmatique d'une autre spécificité : les formes de ces unités cristallines ne correspondent en rien à celles des cristaux connus des minéralogistes depuis longtemps pour ces mêmes variétés minérales.
Il fallut beaucoup plus de temps pour reconnaitre que les unités minérales des squelettes calcaires grandissent par superposition de strates de croissance dont la géométrie est propre à chacune d'elles et que, par conséquent, la croissance des biocristaux ne suit pas la première règle fondamentale de la cristallographie selon laquelle les minéraux cristallins se développent selon des surfaces planes conservant entre elles des angles propres à chaque minéral.
Autre point fondamental, les coquilles, polypiers ou tests divers constituent une exception à l'organisation cellulaire des êtres vivants : alors que ces structures calcaires sont de véritables organes essentiels à la vie des organismes qui les produisent, elles ne sont pas constituées de cellules calcifiées mais de cristaux formés extra-cellulairement.
Second paradoxe : les biocristaux ont des propriétés chimiques et isotopiques spécifiques
Dès 1947, le chimiste H.C. Urey avait suggéré que la mesure du rapport isotopique d'un élément dans un composé devrait permettre de retrouver la température de sa formation. Dûment vérifiée expérimentalement pour les calcaires, cette méthode fut appliquée à une bélemnite (céphalopode) jurassique, avec un succès tel que les variations saisonnières des eaux marines de l'Oxfordien d'Ecosse purent être restituées (2). Un secteur considérable de la recherche paléo-environnementale venait de naître, fondé sur la mesure des fractionnements isotopiques.
Pourtant, il apparut très vite que les niveaux de fractionnement isotopique ou d'incorporation des éléments chimiques mesurés sur les biocristaux n'étaient pas en accord avec les valeurs correspondantes établies in-vitro, avec de fortes différences selon les groupes biologiques. Qui plus est, au cours des variations d'un environnement commun, chaque espèce en enregistre les variations avec une pente qui lui est propre. Si bien que les investigateurs ont dû développer une pratique empirique de l'utilisation des calcaires biogéniques comme traceurs environnementaux. Pour chaque traceur utilisé (proxy) chaque espèce doit être « calibrée » par sa propre courbe de réactivité aux variations de milieu. Bien plus, de nombreuses études ont établi que les régions microstructuralement distinctes d'un même individu enregistrent différemment les variations du milieu de vie de l'animal (Figure 2). La combinaison de la microscopie électronique à balayage pour l'établissement des caractéristiques microstructurales et des instruments permettant des analyses chimiques ou isotopiques ponctuelles (SIMS) a largement confirmé cette propriété pour de nombreux traceurs et des organismes variés (3).
Enveloppes et phases solubles minéralisantes : le double rôle des composés organiques
L'absence des faces de croissance typiques du développement normal des cristaux d'origine chimique, ainsi que le caractère stratifié des biocristaux à l'échelle micrométrique résultant d'une croissance synchronisée sur toute la surface de minéralisation, indiquent à l'évidence que le mode de cristallisation mis en oeuvre est fondamentalement différent du système chimique usuel (germination et croissance en solution saturée).
Un cycle de croissance-micrométrique

L'équipe d'IDES-Orsay s'est appuyée sur quatre méthodes d'observation donnant accès aux échelles micrométriques et infra-micrométriques de l'organisation des biocristaux calcaires pour tenter de comprendre le processus de formation de la strate de croissance élémentaire.
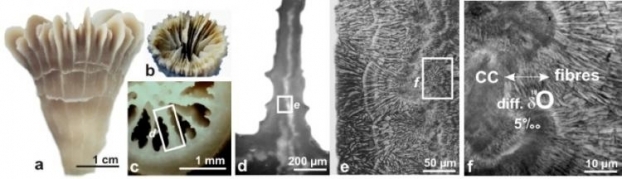
- La fluorescence laser confocale révèle que le cycle de croissance concerne l'ensemble des domaines microstructuraux en construction. Il ne s'agit nullement d'une cristallisation libre: sa régulation est centralisée au niveau individuel (Fig. 3d-e).
- Les cartographies synchrotron (XANES et infrarouge) montrent que la distribution des phases organiques se superpose à celle des phases minérales. Le cycle de croissance associe donc composantes organiques et minérales à une échelle infra-micrométrique (Fig. 3c et k: polysaccharides sulfatés).
- Les images en microscopie de force atomique (mode phase contrast) révèlent que cette superposition des composants organiques et minéraux à l'échelle micrométrique résulte de la structure réticulée du matériel minéral formé d'un assemblage d'éléments nodulaires dont les dimensions moyennes s'établissent à 50-100 nanomètres.
- La microscopie électronique à transmission montre que dans les zones en croissance les nodules initialement amorphes fusionnent en cristallisant (5). L'extension de la cristallisation est limitée pour chaque unité microstructurale par la présence des enveloppes insolubles. La phase organique initialement liée à la phase minérale demeure ainsi incorporée dans la strate de croissance devenue cristalline mais non compacte.
L'état initialement amorphe des nodules visibles au front de la croissance cristalline correspond parfaitement à l'observation antérieure d'un état amorphe transitoire dans la formation du squelette calcaire par les Echinodermes (6). Depuis lors, de nombreux exemples ont révélé la présence d'une phase minérale amorphe dans les biocristaux en croissance.
Ainsi, loin de se développer indépendamment en tant que cristaux distincts, les unités microstructurales s'accroissent synchroniquement, par un processus cyclique concernant simultanément les différentes unités en construction (Fig. 3a-b : prismes calcitiques et 3h-j : fibres coralliennes aragonitiques). Le cycle de croissance est donc la véritable unité de minéralisation dont le fonctionnement doit être déchiffré.
Un nouveau schéma de formation des biocristaux L'intégration de ces données permet aux auteurs de proposer un schéma de formation de la strate de croissance en 3 étapes :
- Il y a d'abord sécrétion d'un matériel organo-minéral par le tissu cellulaire (manteau externe des mollusques ou épithélium basal des coraux par exemple). La phase minérale encore non-cristalline y est stabilisée par une composante organique. Dans tous les groupes d'organismes étudiés, l'épaisseur de cette couche organo-minérale demeure d'ordre micrométrique.
- Le passage à l'état cristallin de la phase minérale s'opère alors, déterminé par un mécanisme encore à déchiffrer mais nécessairement centralisé, ainsi que l'atteste la continuité des strates entre domaines microstructuralement distincts (Fig. 3e, 3i, 3j). La dissociation entre phases organique et minérale conduit à une cristallisation limitée en épaisseur à celle de la strate de croissance et également limitée latéralement par les enveloppes insolubles (dont la stratification propre correspond exactement à celle des strates minérales). C'est le principe essentiel du contrôle biologique de la cristallisation : la cristallisation se développe dans des espaces biologiquement prédéfinis et limités. La présence de phases organiques dont les compositions sont propres à chaque groupe biologique détermine la nature du polymorphe (calcite ou aragonite) et affecte probablement ses modalités de cristallisation, constituant l'origine des caractéristiques spécifiques (chimiques ou isotopiques) des phases cristallisées ("effet vital").
- Au cours de sa cristallisation dans la strate de croissance le réseau minéral repousse à sa périphérie la phase organique qui avait participé au dépôt du matériel minéral initial. Les accumulations irrégulières de cette phase organique résiduelle donnent à la strate de croissance cristallisée son aspect réticulaire caractéristique (Fig. 3f, 3g et 3m). A aucun moment les surfaces libres des éléments nodulaires dont l'association forme le réseau minéral n'expriment les faces cristallines typiques de la variété minérale dont ils sont formés.
Du point de vue de l'utilisation des bio-cristaux comme archives environnementales, chaque strate de cristallisation est donc l'unité d'enregistrement, quasi instantané car généralement plusieurs strates de croissance micrométriques sont produites par jour. Ce mode particulier de cristallisation fournit une perspective pour expliquer les discordances observées de longue date entre les valeurs obtenues par cristallisation in vitro pour un paramètre déterminé et les valeurs correspondantes mesurées sur les calcaires biologiquement formés.
- Note(s)
-
1 Bowerbank J.S. (1844) On the structure of the shells of molluscan and conchyferous animals. Trans. Microsc. Soc. London, 1:123-152.
2 Urey H.C., Lowenstam H., Epstein S., McKinney C.R. (1951) Measurement of paleotemperatures and temperatures of the Upper Cretaceous of England, Denmark and the Southeastern United States. Geol. Soc. Am. Bull. 62: 399-416.
3 Rollion-Bard C., Blamart D., Cuif J.P., Juillet-Leclerc A. (2003) Microanalysis of C and O isotopes of azooxanthellate and zooxanthellate corals by ion microprobe. Coral Reefs 22: 405-415.
4 Adkins J.F., Boyle E. A., Curry W. B. et al. (2003) Stable isotopes in deep-sea corals and a new mechanism for «vital effects». Geochim. Cosmochim. Acta 67(6): 1129-1143.
5 Baronnet A., Cuif 1. P., Dauphin Y., Farre B., Nouet J. (2008) Crystallization of biogenic Ca-carbonate within organo-mineral micro-domains. Mineral. Mag. 72: 617-626.
6 Beniash E., Aizenberg J., Addadi L. et al. (1997) Amorphous calcium carbonate transforms into calcite during sea urchin larval spicule growth. Proc. R. Soc. London B 264: 461-465.
http://biomin.geol.u-psud.fr
http://biocalc.geol.u-psud.fr
- Source :
- Biominerals and Fossils through Time, Cuif J.P., Dauphin Y., Sorauf J.E. (2011), Cambridge University Press, 490 pp., 274 fig.

